Cómo diferenciar un enlace iónico de un enlace covalente
Contenido del Artículo
Las uniones químicas tienen que ver con la nube electrónica, pero sin tocar el núcleo, ya que en caso de tocarse estaríamos hablando de física nuclear o lo que es lo mismo de ruptura de los núcleos. En este caso, estaríamos hablando de unión de átomos a través de los electrones. La forma de combinarse dependerá de la estructura de los átomos, si éstos tienen más cargas positivas o más cargas negativas. Recuerda que los electrones giran alrededor del núcleo, formando una especie de anillos también conocidos como niveles de energía o capas.
Precisamente, en la capa más externa del átomo se superponen o se comparten los electrones dando lugar a los enlaces químicos que pueden ser iónico o covalente.
De forma sencilla, cuando un átomo pierde un electrón se está produciendo un enlace iónico, En cambio, si un electrón es compartido por dos átomos se está produciendo un enlace covalente. Cabe distinguir que si el electrón se comparte por dos átomos al mismo tiempo, se dice que es enlace no polar, pero si uno de los átomos mantiene más tiempo que el otro ese electrón compartido estaríamos hablando de un enlace polar.
Pero por si no te quedó claro, vamos a ver en más detalle cómo diferenciar un enlace iónico de un enlace covalente.
¿Que necesitas para diferenciar un enlace iónico de un enlace covalente?
- Lápiz o bolígrafo y papel para poder seguir los ejemplos que se citan.
- Tabla periódica de los elementos.
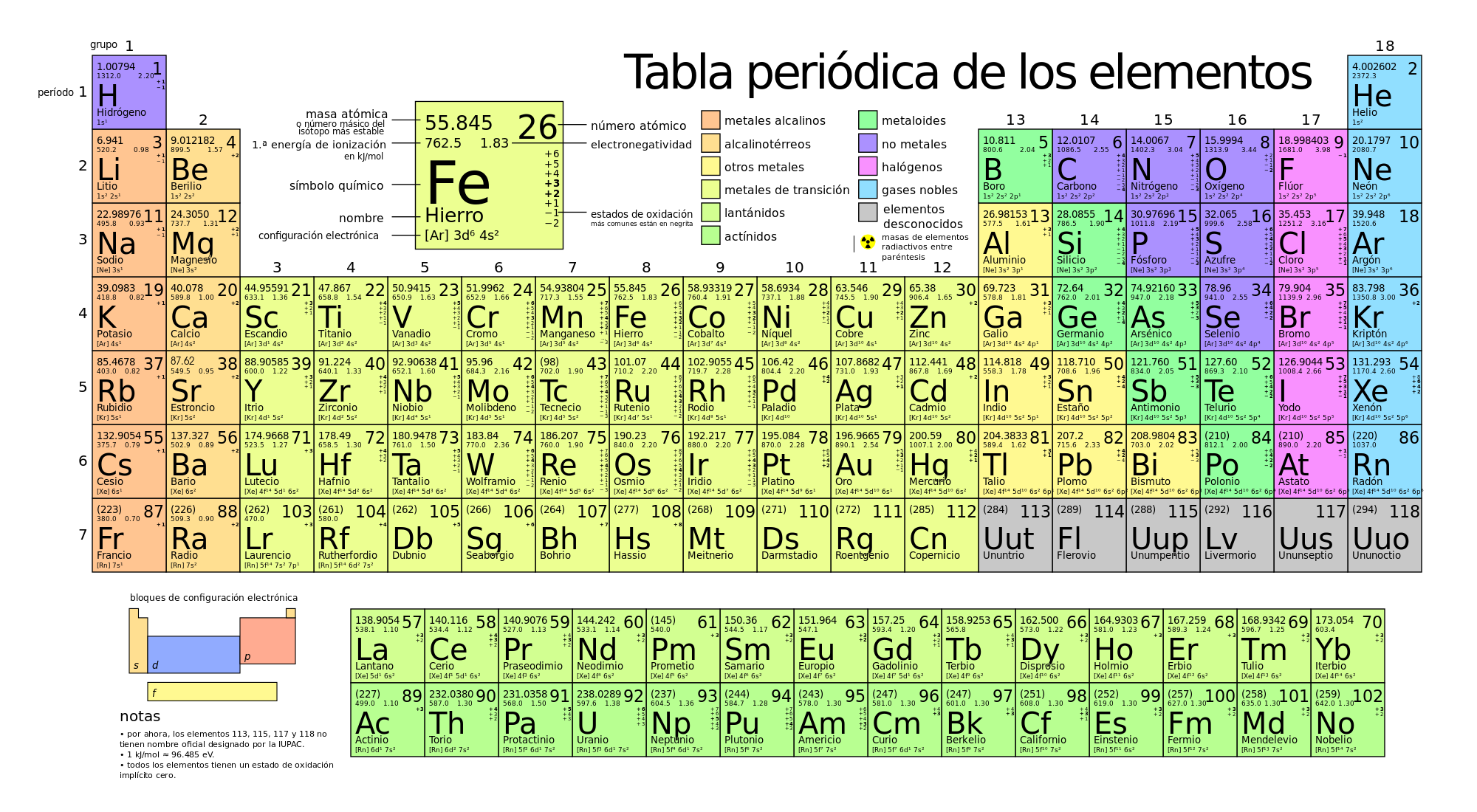
Instrucciones para diferenciar un enlace iónico de un enlace covalente
- Si tienes que explicar a un niño la diferencia entre ambos enlaces esta explicación podrá servirte:
- Imagina que es una familia que vive junta, un padre, una madre y un niño.
- Si todos ellos viven juntos en una misma casa, se está produciendo un enlace covalente no polar. Ambos padres comparten al mismo tiempo el niño.
- Pero si la madre y el padre se separan, lo normal es que la madre tenga más tiempo al niño y los fines de semana los padres se alternen para compartir al niño. Aquí se está dando un enlace covalente polar, ya que la madre tiene más tiempo al niño.
- En el caso de que la madre se vaya a vivir al extranjero el padre ya no podrá ver al niño. Por lo tanto, se ha producido un enlace iónico. Porque el niño ya no puede estar con el padre.
- A continuación vamos a centrarnos más en las características para saber qué es un enlace covalente y qué es un enlace iónico.
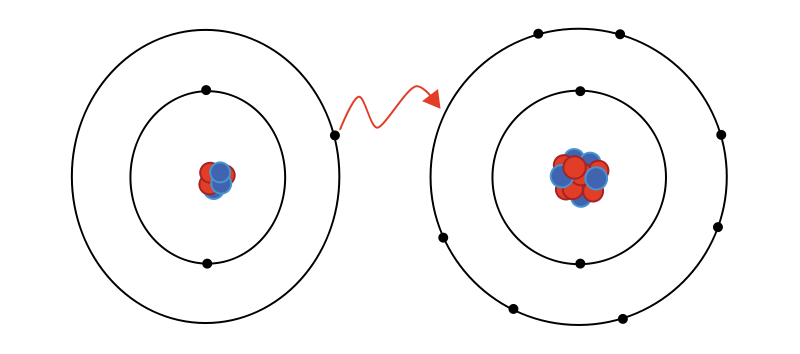
- Los enlaces iónicos
- Se dan entre metales y no metales.
- Hay una transferencia de electrones de los metales a los no metales.
- Se forman iones de signo opuesto y se atraen.
- Se ganan o pierden electrones.
- Ejemplo:Si juntamos una molécula de Sodio (Na) con una molécula de Cloro (CL) , sabemos que Na por estar colocado en la primera columna de la tabla periódica tiene en el último nivel 1 electrón y el Cl 7 electrones. Cuando se produce la transferencia el Sodio al ser metal le transfiere un electrón al cloro. Con lo que el Cloro gana un electrón y el Sodio lo pierde. Ahora al producirse esta transferencia de electrones el Na se ha quedado con más cargas positivas y el Cl tendrá una carga negativa al ganar un electrón. Al ser de cargas opuestas se atraen, juntándose en la molécula NaCl.
- Enlace covalente
- Se da en la unión de dos no metales.
- No dan electrones, sino que los comparten.
- Al compartir completan sus niveles.
- Ejemplo:Si juntamos dos moléculas de oxígeno, ambas tienen 6 electrones en el último nivel. Lo que hacen es compartir porque no son metales. Si intentáramos realizar un enlace iónico tendríamos un oxigeno estable con 8 electrones, pero el otro se quedaría con la mitad. Al ser uno estable y el otro no, no podríamos juntarlos. Por lo que hay que buscar otra forma, que es compartiendo electrones, es decir, estaríamos hablando de un enlace covalente. El compartir electrones implica que cada hidrógeno pone un número de electrones por la zona media que primero dan la vuelta por un átomo y luego por el otro. Por tanto, si comparten cada uno un electrón cada uno tendrá siete electrones. Sin embargo, con 7 electrones aún no son estables y deben compartir un electrón más para llegar a 8 y ser estable. Esto es que cada oxígeno ha compartido dos electrones cada uno. Así estas dos moléculas de oxígeno se juntan en un elemento químico que es el O2, dos átomos de oxígeno unidos mediante un enlace covalente.
- A diferencia de los enlaces iónicos los covalentes sí se pueden clasificar por:
- Su polaridad: polar y no polar.
- Por la forma de compartir electrones: simple, doble, triple o dativo.
Consejos para diferenciar un enlace iónico de un enlace covalente
- Al enlace covalente dativo también se le conoce como coordinado o triple. En este tipo de enlace uno de los dos átomos aporta todos los electrones. Mientras que el enlace covalente puro se comparten el mismo número de electrones.
- En lo referente a la polaridad, tal como explicábamos al principio de este artículo, dependerá de la electronegatividad de los átomos, es decir de la capacidad de atracción del otro elemento. Si no existe diferencia será no polar, como el enlace del Cloro con Cloro. También se dará en el Cloro, Hidrógeno, Oxígeno, Nitrógeno, Fluor, Bromo o Iodo. Siempre que se enlacen entre ellos mismos.




Esta bien me parece concreto
petro hace mejores textos que vos mejor me voy a la guerra a ver como quitarme este casco arriba españa
Me parece bien la información brindada
muy ineresante y se me hizo facil diferenciarlo
¡Muchas gracias! Fue de mucha ayuda.